Nếu đã nhắc đến hóa học chắc chắn bạn không xa lạ với dãy hoạt động kim loại như K, Ba, Na,… Kiến thức này đặc biệt quan trọng giúp học sinh xác định đâu là kim loại mạnh, yếu và cân bằng đúng các phản ứng. Tuy nhiên một số bạn chưa nắm vững điều này, cảm thấy khó khăn khi tiếp thu. Nếu vậy NgonAZ sẽ giải đáp Dãy Hoạt Động Kim Loại là gì? Cách nhớ dãy hoạt động của kim loại nhanh và lâu nhất dưới đây nhé.
Dãy hoạt động kim loại là gì?
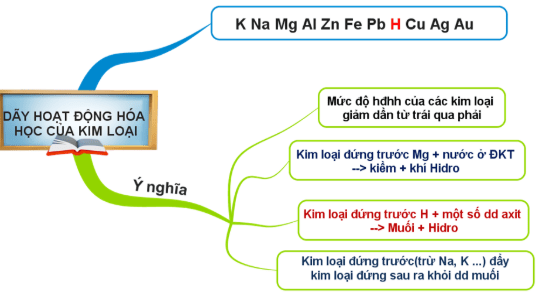
Dãy hoạt động kim loại hay dãy hoạt động hóa học của kim loại được sắp xếp theo chiều giảm dần về mức độ hoạt động hóa học hay khả năng phản ứng của kim loại với các chất khác.
-> Xem thêm: Cấu Hình Electron Nguyên Tử 2022
Các kim loại được sử dụng nhiều nhất tập hợp trong dãy hoạt động hóa học cụ thể như: K, Ca, Mg, Al, Zn, Fe, Sn, Pb, Cu, Hg, Ag, Au.
Với dãy hoạt động kim loại như trên, bạn cần nhớ một số kiến thức quan trọng:
- Mức độ hóa học của các kim loại giảm dần từ trái sang phải
- K là kim loại hoạt động mạnh nhất và Au là kim loại hoạt động kém nhất
- Những kim loại mạnh nhất: Li, K, Ba, Ca, Na
- Những kim loại mạnh: Mg, Al
- Những kim loại trung bình: Mn, Zn, Cr, Fe, Ni, Sn, Pb
- Những kim loại yếu: Cu, Hg, Ag, Pt, Au
- Những kim loại đứng trước Mg (K, Ba, Ca, Na) phản ứng được với nước ở nhiệt độ thường.
– Kim loại đứng trước Mg (K, Ba, Ca, Na) phản ứng được với nước ở nhiệt độ thường.
Ví dụ cụ thể:
+ Khi Na phản ứng với Nước tạo thành NaOH và khí H2
- 2Na + 2H2O → 2NaOH + H2
+ Khi Ba phản ứng với Nước tạo thành Ba(OH)2 và khí H2
- Ba + 2H2O → Ba(OH)2+ H2
– Kim loại đứng trước H tác dụng với dung dịch axit (HCl; H2SO4 loãng,….) tạo ra H2
Ví dụ cụ thể:
+ Khi Fe phản ứng với dung dịch axit HCl tạo thành FeCl2 và khí H2
- Fe + 2HCl → FeCl2 + H2
+ Khi Cu phản ứng với dung dịch axit HCl thì không có phản ứng vì Cu đứng sau H
- Cu + 2HCl → không phản ứng (vì Cu đứng sau H)
– Kim loại không tan trong nước (từ Mg trở về sau) đẩy được kim loại đứng sau nó ra khỏi dung dịch muối
Ví dụ cụ thể:
+ Khi Fe phản ứng với CuSO4 tạo thành FeSO4 và Cu
- Fe + CuSO4 → FeSO4 + Cu
+ Khi Cu phản ứng với AgNO3 tạo thành Cu(NO3)2 và Ag
- Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
– Chú ý: Khi cho Na vào dung dịch CuCl2 thì:
- Na phản ứng với nước trước: 2Na + 2H2O→ 2NaOH + H2
- Sau đó xảy ra phản ứng: CuCl2 + 2NaOH →Cu(OH)2 + 2Ag
-> Xem thêm: Bảng Tuần Hoàn Hóa Học
Ý nghĩa của dãy hoạt động hóa học kim loại
Dãy hoạt động kim loại đóng vai trò rất lớn trong việc quyết định kết quả của phản ứng có xảy ra hay không. Và nếu xảy ra thì cho ra hợp chất như thế nào. Bạn cần lưu ý những điểm dưới đây.
– Độ hoạt động giảm dần từ trái sang phải
Độ hoạt động của dãy kim loại hay còn khả năng phản ứng của các kim loại giảm dần từ K tới Au. Tức là K sẽ phản ứng mạnh nhất. Au sẽ phản ứng kém nhất.
Chúng ta thử phản ứng với nước. Bạn sẽ thấy 5 kim loại đầu tiên K, Na, Ba, Ca, Mg đều tác dụng dễ dàng với nước ở điều kiện thường. Tuy nhiên từ kim loại Mg trở đi khó phản ứng. Như Fe phải tác dụng ở nhiệt độ cao mới có tác dụng. Các kim loại như Au, Sn, Pb còn không phản ứng.
– Dãy hoạt động kim loại tác dụng với O2
Tương tự thí nghiệm với nước, bạn sẽ thấy dãy hoạt động kim loại tác dụng với O2 ở những điều kiện khác nhau:
- Ở nhiệt độ thường: K, Ba, Ca, Na, Mg
- Ở nhiệt độ cao: Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag
- Khó phản ứng: Hg, Pt, Au
– Dãy hoạt động kim loại tác dụng với nước
- Ở nhiệt độ thường: K, Ba, Ca, Na
- Không tác dụng với nước ở nhiệt độ thường: Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
Phương trình hóa học:
- Na + H2O → NaOH + 1/2H2
- Ba + 2H2O → Ba(OH)2 + H2
– Dãy hoạt động kim loại tác dụng với Axit tạo ra muối và giải phóng khí hidro
- Các kim loại tác dụng với axit thông thường giải phóng ra hiđro: K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H)
- Các kim loại không tác dụng: Cu, Ag, Hg, Pt, Au
Các kim loại trong dãy phản ứng với axit tạo ra muối và khí hidro phải thỏa mãn hai điều kiện:
- Kim loại đứng trước nguyên tố hidro trong dãy hoạt động hóa học
- Dung dịch axit phản ứng phải là axit loãng
Ví dụ: Fe + 2HCl → FeCl2 + H2
– Dãy hoạt động kim loại tác dụng với muối
- Kim loại của đơn chất phải đứng trước kim loại của hợp chất (xét trong vị trí của dãy hoạt động hóa học)
- Kim loại của đơn chất phải bắt đầu từ Mg trở về sau (tức là: Mg, Al, Zn…)
Ví dụ: Phản ứng giữa Magie với muối của sắt:
- Mg + FeCl2 → MgCl2 + Fe
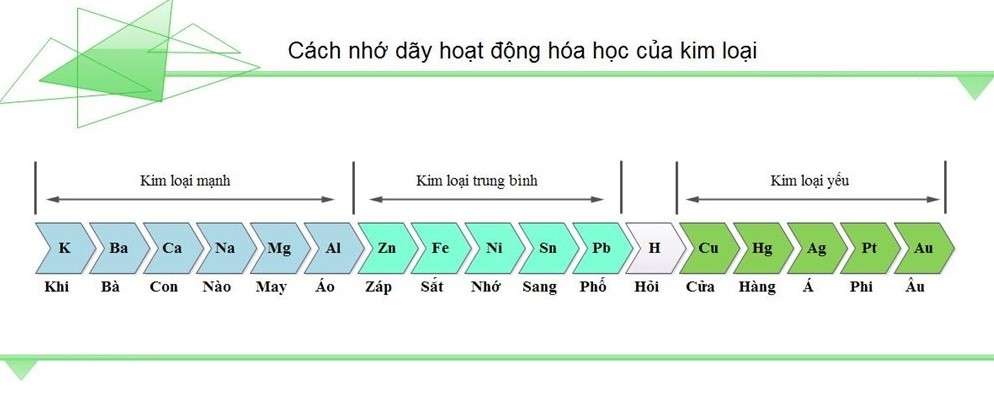
Cách học thuộc dãy hoạt động hóa học kim loại
Nhìn dãy hoạt động hóa học kim loại nhiều bạn đã cảm thấy hoa mắt đúng không nào. Đừng lo lắng vì chúng tôi sẽ mách mọi người mẹo nhớ nhanh và lâu nhất.
– K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Khi cần nàng may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu
- Khi cả nhà may áo giáp sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
– Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Lúc khó bà cần nàng may áo màu giáp có sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
Lời kết
Như vậy, bạn đã hiểu rõ được ý nghĩa của dãy hoạt động hóa học kim loại như trên. Sau khi nắm đầy đủ kiến thức, mọi người không còn phải lúng túng khi cân bằng các phản ứng sao cho đúng, chính xác. Hi vọng với kiến thức, bạn sẽ yêu thích môn Hóa hơn nhé.